“因材施教,精准用药”- 浅析β受体阻滞剂的异质性
作者:湖南憧燚科技有限公司
六十年前Black 等人发现了普萘洛尔用于治疗心绞痛,后来用于治疗高血压以及其他心血管疾病。随后后续的研究发现了β肾上腺素受体具有不同亚型,陆续上市多种β受体阻滞剂,每种β受体阻滞剂具有不同受体选择性,亲水性和亲脂性也不同,这样不同的β受体阻滞剂针对疾病类型的患者选择也不同,本文重点赘述不同β受体阻滞剂的区别。
β受体阻滞剂的分布及作用
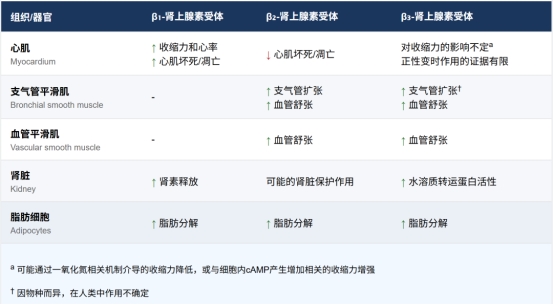
β1-肾上腺素受体主要表达于心脏、肾脏和脂肪细胞。心脏β1-肾上腺素受体的激活(主要由交感神经释放的去甲肾上腺素或肾上腺皮质释放的肾上腺素介导)会激活腺苷酸环化酶,导致心肌细胞内的环磷酸腺苷增加。这进而促进细胞外钙离子流入心肌细胞,从而增强收缩力(及耗氧量)和心率(通过增加窦房结起搏点和房室结组织的传导速度)。β1-肾上腺素受体刺激的强度受交感神经系统和副交感神经系统之间的平衡调节,该平衡由位于颈动脉窦的压力感受器调节。心脏中β1-肾上腺素受体的密度以约4:1的比例超过β2-肾上腺素受体,尽管在射血分数降低的心力衰竭或某些其他心血管疾病的情况下,该比例可能降至低至1:1。
β2-肾上腺素受体主要表达于血管系统和气道平滑肌,同时也在心脏及其他多种细胞类型中有一定程度表达。β2-肾上腺素受体的激活通过环磷酸腺苷依赖性机制引起平滑肌松弛,该机制涉及蛋白激酶A的活化,从而减少钙离子内流、隔离并储存细胞内钙(与上述心肌细胞中β1-肾上腺素受体的作用相反)。因此,刺激β2-肾上腺素受体可导致血管舒张、血压降低及反射性心动过速。β2-肾上腺素受体的激活还能增加能量消耗并改善葡萄糖稳态。另一方面,阻断β2-肾上腺素受体会引起血管收缩(伴随四肢血流减少)、支气管收缩及代谢功能紊乱。肾上腺素激活β2-肾上腺素受体的效能强于去甲肾上腺素,且在生理条件下是维持β2-肾上腺素受体张力的主要调节因子。
β3-肾上腺素受体是β-肾上腺素能功能知识体系中相对较新的成员,于1989年被克隆。激活β3-肾上腺素受体会增加一氧化氮的产生,从而降低心脏收缩力并诱导外周动脉血管舒张;这些作用可能拮抗β1或β2-肾上腺素受体的过度激活,构成潜在的心脏保护机制。值得注意的是,衰竭心脏中β3-肾上腺素受体的表达会增强,实验证据表明慢性心力衰竭状态下心脏β3-肾上腺素受体的上调可能促进正性肌力作用。此外,该受体能激活棕色脂肪组织并诱导白色脂肪组织棕色化,伴随产热和能量消耗的增加。因此,β3-肾上腺素受体激动剂作为抗肥胖药物的潜力已引发研究热潮。
β受体阻滞剂药代动力学

受体的选择性

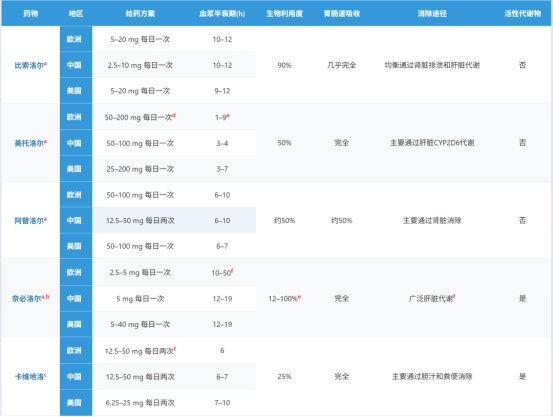
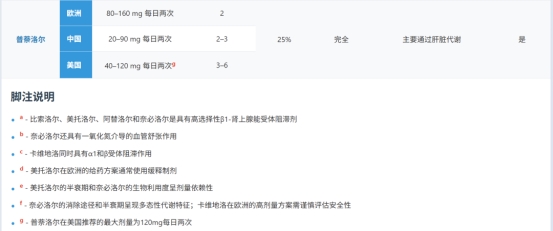
在使用克隆人β肾上腺素受体测量不同β受体阻滞剂选择性的实验中,比索洛尔和扎莫特罗对β1受体的选择性最高(14倍选择性),其次是阿替洛尔(4.7倍选择性)、醋丁洛尔(2.4倍选择性)和美托洛尔(2.3倍选择性)。关于比索洛尔与奈必洛尔的β1选择性比较研究结果存在差异:在人心肌组织研究中显示奈必洛尔具有更高选择性,而在使用克隆β肾上腺素受体的研究中则显示比索洛尔更具选择性。
对已发表荟萃分析的再分析表明,阿替洛尔在降低高血压患者不良心血管结局风险方面可能不如其他β受体阻滞剂有效,尽管该发现的原因尚不明确。在COMET研究中发现,对于射血分数降低的心力衰竭(HFrEF)患者,使用相对高剂量的卡维地洛(具有额外α1肾上腺素受体阻断作用的非心脏选择性β受体阻滞剂)相较于低效价剂量的美托洛尔(心脏选择性β受体阻滞剂)可带来生存获益:这一发现强调了在比较不同β肾上腺素受体选择性的药物时,考虑等效剂量的重要性。
β2肾上腺素受体阻断是β受体阻滞剂重要不良反应的原因,包括支气管收缩、血糖代谢异常和勃起功能障碍。高度β1选择性的β受体阻滞剂在完全阻断β受体的剂量下,对外周血管系统影响极小或无影响,这一点与非选择性或低选择性药物不同。同样,心脏选择性β受体阻滞剂对气道平滑肌(这类药物在阻塞性气道疾病患者中无绝对禁忌症)、葡萄糖代谢或勃起功能的影响甚微。部分关于β受体阻滞剂致勃起功能障碍的报告可能存在反安慰剂效应,可能源于患者被告知预期该副作用。这些发现具有重要意义,因为有证据表明β受体阻滞剂在气道疾病或糖尿病人群中使用不足,导致患者无法获得这些药物带来的预后获益。最后,相较于非选择性β受体阻滞剂,心脏选择性或血管扩张型β受体阻滞剂引起血压变异性升高的报告较少。大多数高血压患者将接受降压联合治疗,且钙通道阻滞剂降低血压变异性的效应在联用其他降压药物时仍可持续。
亲脂性
β受体阻滞剂在物理化学性质上存在显著差异。亲脂性β受体阻滞剂比亲水性β受体阻滞剂更容易进入中枢神经系统(CNS)并在其中发挥药理作用。吲哚洛尔、噻吗洛尔和普萘洛尔具有高度亲脂性;纳多洛尔、阿替洛尔和拉贝洛尔则具有高度亲水性;而美托洛尔、比索洛尔、奈必洛尔、醋丁洛尔和卡维地洛则表现出中等程度的亲脂性/亲水性。有报道称,β受体阻滞剂治疗可能在某些患者中诱发神经精神系统副作用,这引发了以下假设:β受体阻滞剂的亲脂性程度可能预测其中枢神经系统副作用的风险。然而一项荟萃分析驳斥了这一假设,该分析表明药物在中枢神经系统作用相关的副作用(抑郁、疲劳、性功能障碍)的发生率与所处方药物的亲脂性程度无关。
反向激动作用
β肾上腺素受体与许多G蛋白偶联受体类似,在无激动剂存在时仍维持基础水平的细胞内信号转导。反向激动剂是一种与受体结合并通过稳定受体构象来降低其固有活性的分子,即其作用与激动剂相反。大多数作用于β1和β2肾上腺素受体的配体都表现出至少一定程度的反向激动作用。该现象可降低受体脱敏速率,并增加心脏或血管细胞表面的受体密度。研究发现不同β受体阻滞剂的反向激动活性存在差异,阿替洛尔、美托洛尔、奈必洛尔和比索洛尔的反向激动活性高于卡维地洛。然而,目前缺乏证据表明β1肾上腺素受体反向激动作用的存在与否具有明确临床获益,β受体阻滞剂的其他药理学特性可能对界定其治疗和临床特征更为重要。
透析性
接受血液透析治疗的患者虽普遍合并高血压(该人群高血压患病率高达80%),却大多被排除在临床试验之外。研究发现,在美国医疗保险体系中接受终末期肾功能衰竭透析治疗的患者中,64%正在使用β受体阻滞剂。在各类β受体阻滞剂中:阿替洛尔和美托洛尔具有高度可透析性(即透析可有效清除血液循环中的药物);比索洛尔具有中度可透析性;而卡维地洛、奈必洛尔和普萘洛尔的药物浓度受透析影响甚微。
β1-肾上腺素受体的内在拟交感活性(ISA)
部分β受体阻滞剂具有ISA特性,可作为β1或β2肾上腺素受体的部分激动剂。具有ISA的非选择性β受体阻滞剂可能激活β2受体并诱导外周血管舒张。对于具有ISA的心脏选择性β受体阻滞剂,其降低心率和收缩力的药效学作用相较于无ISA药物可能减弱;而对非选择性β受体阻滞剂,ISA可能减轻肢体不良反应或寒冷感。然而,尚无确凿证据表明针对β1受体的ISA能带来临床获益;事实上,荟萃分析显示ISA的存在反而降低了β受体阻滞剂对稳定性冠心病患者的临床效益。一项安慰剂对照研究中,扎莫特罗(具有显著β1受体ISA活性的β阻滞剂)在严重症状性HFrEF患者(NYHA III-IV级)中仅轻度改善呼吸困难程度,对其他症状影响甚微。值得注意的是,随机接受扎莫特罗治疗的患者在随机分组后100天内死亡率较对照组高出两倍以上(9.1% vs. 3.7%,p=0.02)。另一项随机试验表明,布新洛尔(另一种具有β1受体ISA活性的β阻滞剂)相较于安慰剂在NYHA III-IV级HFrEF患者中未显示生存获益。无ISA的β受体阻滞剂可明确改善心衰预后;专家观点指出,缺乏ISA特性是获得最佳临床结局的关键前提。
具有血管舒张机制β受体阻滞剂
外周血管扩张还可通过上调一氧化氮生成实现,例如奈必洛尔通过激活β3-肾上腺素受体介导此效应。无论何种机制引起的血压下降,其可能引发的反射性心动过速均会被β1-肾上腺素受体阻断作用所抵消——相较于心脏选择性β阻滞剂,这种阻断作用能最大限度减少心率波动。然而,尚无明确证据表明针对β2或β3肾上腺素受体的部分激动活性比心脏选择性β阻滞剂具有额外预后优势。在一项小型单盲试验中,高度心脏选择性且无内在拟交感活性的比索洛尔与具有β3受体激动活性的高度心脏选择性药物奈必洛尔降压疗效相当。尽管目前缺乏血管扩张型与非血管扩张型β阻滞剂的头对头随机预后试验,但荟萃分析显示比索洛尔与奈必洛尔治疗心衰患者的临床结局相似,文献综述也表明两者在心血管疾病患者中的疗效相当。一项大型观察性研究通过倾向评分匹配发现,接受第一代(无附加血管扩张活性)与第三代(具有附加血管扩张活性)β阻滞剂治疗的高血压患者临床结局无显著差异。最后,卡维地洛、拉贝洛尔、塞利洛尔和布新洛尔均可阻断α1-肾上腺素受体,这构成了诱导外周血管扩张的附加机制。值得注意的是,尽管存在血管扩张相关反射性心动过速的潜在风险,卡维地洛仍能有效降低心率。这些发现具有重要临床意义,因为心率降低被认为是改善心衰患者预后的关键机制。
联合治疗
2023年最新发布的欧洲高血压学会(ESH)临床实践指南将β受体阻滞剂纳入适合一线使用的五大类降压药物。这主要基于以下认识:降低心血管不良事件风险的关键在于血压下降幅度本身,而非不同降压药物的药理特性差异。由于卒中结局对中心动脉压尤为敏感,β受体阻滞剂在降低中心动脉压方面略逊于其他药物(尤其是钙通道阻滞剂),可能削弱其降低卒中风险的效力。然而,鉴于多数高血压患者需联合用药才能有效控制血压,β受体阻滞剂降低中心动脉压的效能不足并非关键限制因素。虽然血管紧张素转换酶抑制剂与钙通道阻滞剂的联合常作为首选方案,但对特定患者(尤其合并冠心病或HFrEF者),选择性β受体阻滞剂仍可成为合理联合方案的组成部分。例如,在显著降低中心动脉压的二氢吡啶类钙通道阻滞剂基础上,联用心脏选择性β受体阻滞剂可通过阻断心脏β1肾上腺素受体,产生协同性外周血压下降效应。值得注意的是,钙通道阻滞剂还能增加血管一氧化氮生物利用度或阻断α1肾上腺素受体,这些机制均有助于降低中心动脉压。
交感神经系统激活会增强RAAS活性,而RAAS又进一步促进交感神经过度兴奋,形成恶性循环,推动高血压靶器官损害和心力衰竭的发展。因此,心脏选择性β受体阻滞剂与RAAS抑制剂(血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂)联用构成高血压及其他心血管疾病的合理治疗策略。重要的是,在现有单药治疗基础上加用β受体阻滞剂的降压效果与其他降压药物相当。RAAS激活还会降低高血压或HFrEF患者对利尿剂的反应性,这为β受体阻滞剂-利尿剂联合方案在此类患者中的疗效提供了理论依据。最后,通过固定剂量单片复方制剂实施降压联合治疗有助于维持治疗依从性,这对实现最佳血压控制目标至关重要。
当前心衰管理指南推荐对HFrEF患者使用β受体阻滞剂(主要为比索洛尔、美托洛尔或卡维地洛)。值得注意的是,在近期HFpEF人群的随机试验中,近90%受试者接受β受体阻滞剂作为背景治疗。参与这些试验的心脏病学家发现,多数HFpEF患者因心动过速(包括快速房颤)及左室肥厚/大血管冠状动脉疾病所致心肌缺血等适应症而需使用β受体阻滞剂。在HFrEF治疗中,β受体阻滞剂需与其他具有降压作用的支柱药物联用,包括RAAS抑制剂或血管紧张素受体-脑啡肽酶抑制剂、盐皮质激素受体拮抗剂以及钠-葡萄糖协同转运蛋白2抑制剂。